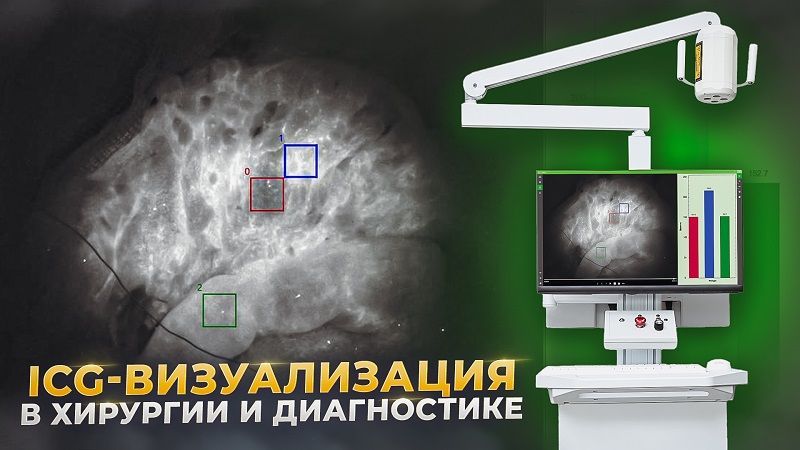
Медицинское оборудование для интраоперационной флуоресцентной визуализации с использованием индоцианина-зеленого (ICG)
Молекулярная визуализация, основанная на флуоресценции в ближней инфракрасной области (NIRF), имеет огромный потенциал в качестве нового метода медицинского обследования в месте оказания медицинской помощи.
Поручикова О.Л., Грачев П.В.
- Актуальность
- История применения и первый опыт
- Преимущества использования ICG в медицинских приборах
- Источники падающего света для сбора индоцианиновой зеленой флуоресценции
- Коллимационная оптика
- Детекторы площади
- Обзор медицинских моделей
- Как происходит определение параметров кровотока с помощью флуоресцентной ангиографии в системе «МАРС»
- Флуоресцентная диагностика лимфатической системы с помощью системы «МАРС»
- Заключение
- Список литературы
Актуальность
Молекулярная визуализация, основанная на флуоресценции в ближней инфракрасной области (NIRF), имеет огромный потенциал в качестве нового метода медицинского обследования в месте оказания медицинской помощи. Метод может, без использования радиактивных веществ, обеспечивать чувствительность, сравнимую с методами ядерной медицины, что позволяет избежать ограничений на его использование.
Так, к примеру, использование визуализации NIRF для хирургической резекции злокачественного новообразования с молекулярным контролем может значительно снизить остаточную опухолевую массу, а также хирургическую заболеваемость, связанную с иссечением избытоточного обьема тканей, чтобы избежать «положительных» хирургических краев [1].
Глубина ткани, концентрация и доза, при которой визуализирующий агент может быть обнаружен в тканях, зависят от нескольких факторов. Наиболее важна чувствительность устройства визуализации.
В последнее время устройства визуализации NIRF, использующие индоцианин зеленый (ICG), стали доступны на рынке и были включены в клинические исследования.
ICG был одобрен в США для внутривенного использования еще в 1956 году, однако в последние годы активно используется нутритканевое (интерстициальное) введение, что позволяет проводить флуоресцентную визуализацию лимфатических сосудов и узлов [2].
За последние несколько лет интраоперационная визуализация с использованием индуцированного невидимым индоцианином зеленым (ICG) флуоресцентного света ближнего инфракрасного диапазона (NIR) вошла в операционную, чтобы заполнить пробел между сложной предоперационной визуализацией (МРТ,КТ,УЗИ) и интраоперационной реальностью [3].
История применения и первый опыт
Впервые флуоресценция была описана в 1852 году британским учёным Джорджем Стоксом в книге «Об изменении преломляемости света». В ходе экспериментов с облучением флюорита (плавикового шпата) ультрафиолетом наблюдалось свечение красного цвета. В честь минерала флюорита процесс назван флуоресценцией (Флуоресценция – нетепловое свечение веществ в видимом диапазоне во время их облучения (чаще в ультрафиолетовом диапазоне). Перспективным оказалось применение индоцианина зеленого. Единичные экспериментальные работы по этой теме относятся к 60-м годам XX века. А приблизительно с 2005 г., после накопления доказательной базы, технология вошла в повседневный арсенал передовых центров хирургии, в первую очередь кардиохирургии и пластической хирургии. К концу 2015 г. в мире опубликовано около 6000 статей и работ по диагностике с использованием индоцианина зеленого. Число публикаций растет из года в год.
Архитектура устройств для фрюоресцентной визуализации может существенно различаться, однако во всех присутствуют одинаковые основные компоненты :
- источник света для возбуждения ICG;
- оптические фильтры для отделения излучаемых флуоресцентных сигналов от сильного обратно рассеянного возбуждающего света и сигналов окружающего света;
- детектор площади для обнаружения испускаемых флуоресцентных сигналов.
Производительность устройства в конечном итоге определяется этими основными компонентами, требующими различных дозировок ICG в диапазоне от микрограммов до миллиграммов на инъекцию для визуализации лимфатических сосудов.
Первый опыт использования ICG для интраоперационной визуализации был проведен в 2007 году в Великобритании. Доктор Майкл Слейтер и его коллеги использовали ICG для диагностики рака молочной железы у пациентки. Они ввели ICG внутривенно и затем провели флуоресцентное сканирование грудной клетки пациентки. Благодаря этому они смогли определить наличие опухоли и ее размер.
Преимущества использования ICG в медицинских приборах
NIR флуоресцентная визуализация имеет несколько преимуществ. Первым преимуществом является низкая скорость всасывания в тканях человека. Поглощение света гемоглобином и водой может снизить яркость и эффективность визуализации. Спектр NIR находится между длинами волн около 800 нм. Он имеет минимальное поглощение по сравнению с другими длинами волн. Во-вторых, этот диапазон NIR имеет низкое рассеяние в тканях, что обеспечивает глубокое проникновение. В-третьих, низкая автофлуоресценция в ближнем инфракрасном диапазоне. Автофлуоресценция особенно высока в свете с длиной волны короче 600 нм. Это связано со многими эндогенными флуорофорами, такими как гемоглобин, миоглобин и цитохромы.
Следовательно, длина волны NIR обеспечивает меньшую автофлуоресценцию, более глубокое проникновение в ткани и более легкое отделение от стандартного коэффициента отражения белого света.
Красители, используемые для флюоресцентного контроля NIRF, подразделяются на несколько категорий, включая цианины, аналоги родамина, 4,4-дифтор-4-бора-3а, 4а-диаза-s-индацен (BODIPY), скваарины, фталоцианины и производные порфирина, а также другие родственные красители.
ICG представляет собой водорастворимый анионный амфифильный флуорофор, обладающий особой привлекательностью благодаря своему возбуждению (λ ex =778 нм) и испусканию (λ em =830 нм). ICG, который флуоресцирует при 800 нм, является единственным контрастным веществом NIR, одобренным FDA и Европейским агентством по лекарственным средствам (EMA) [4].
Источники падающего света для сбора индоцианиновой зеленой флуоресценции
Источники возбуждающего света в системах флуоресцентной визуализации ICG:
- лазерные диоды;
- светоизлучающие диоды (LED);
- источники ламп с фильтрами, которые имеют типичные спектры.
Лазерные диоды обладают наибольшей чувствительностью, т.к. »фон», вознгикающий из-за « просачивания» обратно рассеянного возбуждающего света, является самым низким, поскольку подача обратно рассеянного возбуждающего света осуществляется спектрально с помощью интерференционных фильтров. Напротив, светодиоды генерируют более широкий диапазон длин волн с относительно меньшей выходной мощностью, что требует объединения десятков светодиодов для получения требуемой мощности на квадратный сантиметр падающего света. У ламп источники фильтруются для генерации возбуждающего света с узкой полосой. При этом вырабатывается избыточное тепло, которое необходимо рассеивать, чтобы продлить срок службы фильтра. Кроме того, лампы с фильтрами имеют низкую эффективность, что затрудняет их подключение к оптическому волокну. Лазерные диоды и светодиоды широко используются в системах флуоресцентной визуализации ICG. Можно было бы ожидать, что большее количество падающего возбуждающего света (измеряемое как «флюенс» в милливаттах на квадратный сантиметр) приведет к большей флуоресценции ICG и большему количеству собранного флуоресцентного сигнала. Существуют пределы максимально допустимого воздействия (ПДВ) как для безопасности глаз, так и для безопасности кожи. ПДВ Американского национального института стандартов (№ 13997) для воздействия на глаза лазерного луча с длиной волны 700–1050 нм составляет 10.2( λ -0,700) × 10 -3 Вт см -2 при продолжительности от 10 до 30 000 с, а ПДВ воздействия на кожу составляет 0,2 × 10 2( λ -0,700) Вт см -2 (где длина волны λ равна выражается в микрометрах). Для 785 нм предел безопасности для глаз составляет 1,48 мВт/см2, а для кожи – 296 мВт/ см2. Все лазерные устройства, используемые в клинических исследованиях, вероятно, превышают ПДВ для безопасности глаз, но безопасны для кожи. Следует отметить, что устройства, превышающие ПДВ, требуют использования средств защиты глаз пациента и мер предосторожности для медицинского персонала. Кроме того, при большей падающей мощности возбуждения возникает большее обратное рассеяние света, что может способствовать получению высокого фона, плохому сбору слабых сигналов ICG и ограничению производительности устройства [5].
Коллимационная оптика
Все без исключения системы флуоресцентной визуализации ICG обладают чувствительностью обнаружения, которая ограничена фоновыми сигналами (или минимальным шумом), возникающими из-за одного или нескольких факторов:
- спектральное перекрытие между обратно рассеянным возбуждающим светом и собранной флуоресценцией ICG, приводящее к тому, что не флуоресцентные сигналы регистрируются как флуоресценция;
- «синее смещение» оптических фильтров, которое позволяет проходить неколлимированному обратно рассеянному возбуждающему свету, обычно не падающему на поверхность фильтра;
- ограниченная оптическая плотность оптических фильтров, которая пропускает небольшое количество окружающего света и света возбуждения, который все еще значителен по сравнению со слабой собранной флуоресценцией ICG.
Если собирается свет, который не исходит от флуоресцентного красителя, присутствующего в тканях, то он представляет собой «минимальный уровень шума», что снижает вероятность того, что устройство может отображать небольшие количества агента NIRF в тканях.
Также важно отметить, что на чувствительность флуоресцентного устройства формирования изображения может влиять среда, в которой оно используется. Хотя невозможно работать в полной темноте, вариации окружающего освещения, независимо от того, обеспечиваются ли они флуоресцентными лампами или лампами накаливания в помещении, хирургическими лампами или освещением белым светом в эндоскопических или лапароскопических устройствах, могут иметь небольшой, но значительный спектральный вклад в спектральных полосах частот, в которых собирают флуоресценцию ICG.
Детекторы площади
В настоящее время детекторы с зарядовой связью (ПЗС) в основном используются в системах флуоресцентной визуализации ICG и зависят от интегрирования собранных фотонов в миллисекундных временных рамках. Используемые ПЗС-детекторы можно разделить на:
- ПЗС с передней и задней засветкой (FCCD и BCCD);
- ПЗС с электронным умножением (EMCCD)%
- ПЗС с усилением (ICCD), включая переднюю и заднюю ICCD с подсветкой в зависимости от их конфигурации.
Большинство систем визуализации, применяемых у человека, используют либо FCCD, либо BCCD. FCCD сконструированы аналогично человеческому глазу за счет ориентации поликремниевых затворов спереди, проводки посередине и фотодиодов для сбора света сзади. Эта конфигурация блокирует попадание падающего света на фотодиоды, что приводит к относительно низкому QE. BCCD содержат те же элементы, но за счет перестановки структуры затвора в задней части светочувствительной области ПЗС и уменьшения толщины слоя кремния с помощью запатентованных методов травления BCCD имеют более чем двукратное улучшение QE, чем их передняя часть - светящиеся аналоги. В отличие от обычных ПЗС, EMCCD имеет дополнительный регистр электронной эмиссии, установленный между обычным последовательным регистром и выходным усилителем для умножения слабых сигналов. Регистр EM разбит на несколько сотен каскадов, и каждый каскад действует как лавинный диод для умножения сигнала. Степенью усиления умножения можно управлять, изменяя тактовое напряжение, подаваемое на регистр EM.
Напротив, ICCD имеют другой механизм умножения, в котором собранное изображение усиливается до того, как оно будет зарегистрировано ПЗС. Усилитель состоит из трех основных компонентов: фотокатода, ЭМ микроканальной пластины (МКП) и люминофорного экрана. Фотокатод преобразует низкий уровень входящего света в электроны, которые затем ускоряются сильным электрическим полем по направлению к МКП, и, наконец, усиленный сигнал снова преобразуется в световой сигнал на люминофорном экране. В усилителях поколения III, чувствительных к БИК, тонкая пленка из спеченного оксида алюминия прикреплена к МКП для защиты фотокатода от паразитных обратно рассеянных ионов. Усилители поколения II более распространены, но им не хватает чувствительности к NIR-свету усилителей поколения I.
Потенциальные источники шума в этих ПЗС-устройствах состоят из присущего сигналу дробового шума, шума темнового тока и шума считывания. Дробовой шум возникает из-за внутренних статистических флуктуаций числа фотонов, падающих на ПЗС, и представляет собой предел обнаружения детектора. Для ICCD и EMCCD дробовой шум является функцией среднего потока падающих фотонов, усиления умножения, QE, времени интегрирования и коэффициента шума, который характеризует шум, вносимый процессом усиления. Шум темнового тока возникает из-за статистической вариации числа термически генерируемых электронов, которые накапливаются в пикселях всех ПЗС. Скорость генерации темнового тока сильно зависит от температуры ПЗС и особенно важна для EMCCD, поскольку она умножается на коэффициент умножения на кристалле. Для ICCD дополнительный шум темнового тока создается спонтанным выходом электронов из фотокатода усилителя и усиливается коэффициентом усиления усилителя. Охлаждение ПЗС может снизить шум темнового тока до незначительного уровня в течение типичного интервала экспозиции в высокопроизводительных ПЗС-камерах. Шум считывания представляет собой комбинацию компонентов системного шума, присущих процессу преобразования носителей заряда ПЗС в аналоговый сигнал напряжения для количественного определения, и последующего аналого-цифрового (АЦП) преобразователя, который преобразует аналоговый сигнал напряжения в цифровое представление. Для EMCCD шум считывания состоит из двух компонентов: шума переноса заряда, возникающего из-за эффекта умножения регистра усиления, и всех других неумноженных шумов считывания. Шум считывания становится доминирующим в обычных ПЗС, работающих на высокой частоте считывания кадров. Исследования показали, что характеристики изображения ПЗС-систем поколения III превосходят характеристики ПЗС-систем без усиления, как по отношению сигнал/шум, так и по отношению цель/фон, когда время интегрирования ПЗС-камеры составляет <200 мс.
Обзор медицинских моделей
Исследовательские и продаваемые импортные устройства для флуоресцентной визуализации в ближнем инфракрасном диапазоне
Наблюдается устойчивый рост числа коммерчески продаваемых систем FGS, каждая из которых имеет свои отличительные рабочие характеристики и спецификации.
Для успешной работы необходим набор желаемых критериев для оценки инструментов, в том числе:
- наложение в реальном времени изображений белого света и флуоресценции,
- работа в условиях окружающего комнатного освещения,
- чувствительность наномолярного уровня,
- количественные возможности,
- одновременная визуализация нескольких флуорофоров,
- эргономическая полезность для открытой хирургии.
Наложение флуоресценции в реальном времени на изображения RGB в белом свете и работа в режиме флуоресценции при окружающем комнатном освещении предлагаются в качестве наиболее важных требований, поскольку эти аспекты ограничивают полезность системы, если она отсутствует, независимо от ее чувствительности. Чувствительность к низким концентрациям флуорофора испособность линейного количественного определения относительных концентраций флуорофоров является следующей по важности в порядке ранга, поскольку они в конечном итоге будут определять клиническое использование устройства визуализации. Кроме того, поскольку внедрение флуоресцентной визуализации для хирургического контроля продолжает расти, количественные возможности будут играть важную роль в сравнении данных многоцентровых исследований и сравнении результатов в пространственном и лонгитюдном масштабе как внутри, так и среди пациентов. Кроме того, возможность одновременной мультифлуорофорной визуализации является «дополнительной» функцией для большинства пользователей, но может иметь решающее значение для исследовательских лабораторий, разрабатывающих визуализирующие агенты нового поколения и методы для улучшения оценки распространенности рака и оценки границ с использованием комбинаций визуализирующих агентов. Наконец, мы обсудили эргономику. Как последний важный критерий выбора системы, так как он опять же сильно зависит от полезности системы во время операции.
Устройства визуализации NIRF могут быть разделены на следующие группы (рис.1):
- портативные [включая HyperEye Medical System (Mizuho Medical), FLUOBEAM (Fluoptics, Гренобль, Франция), PDE (Hammatsu Photonics Co., Хамамацу, Япония), IC- View (Pulsion Medical Systems SE, Фельдкирхен, Германия) и Visual Navigator (SH System, Сеул, Республика Корея)],
- на базе тележки (включая устройство формирования изображений FDPM, mini-FLARE, SPY и прототип хирургической навигационной системы),
- встроенные в существующие устройства, такие как робототехническая система da Vinci® (Novadaq Technologies Inc.), путем включения возможности NIR-освещения и обнаружения (включая INFRARED™ 800™, FIREFLY™ и лапароскопическую систему NIRF).
Плотность потока источника света для возбуждения флуоресценции варьируется в этих системах в диапазоне <1,9–31 мВт/см2. Длины волн возбуждения флуоресценции в этих системах также различны. Например, FLUOBEAM, FDPM imager, SPY и FIREFLY используют лазерные дидо, работающие на длинах волн 750, 785 и 806 нм соответственно. В mini-FLARE, PDE, HyperEye Medical System и Visual Navigator используются светодиоды с центральной длиной волны 760 или 740 нм. INFRARED 800 и FIREFLY используют отфильтрованный ксенон с длиной волны от 700 до 800 нм. ПЗС-камеры в этих системах имеются различные динамические диапазоны и время интегрирования от 0,1 до 1000,0 мс. Длины волн сбора в этих системах в основном сосредоточены на 830 нм, что близко к пику излучения флуорофора ICG и при котором ПЗС-камеры имеют умеренно высокую чувствительность. Некоторые системы, такие как SPY и PDE, имеют фиксированное рабочее расстояние (WD) 30 и 20 см соответственно (рис 1.)
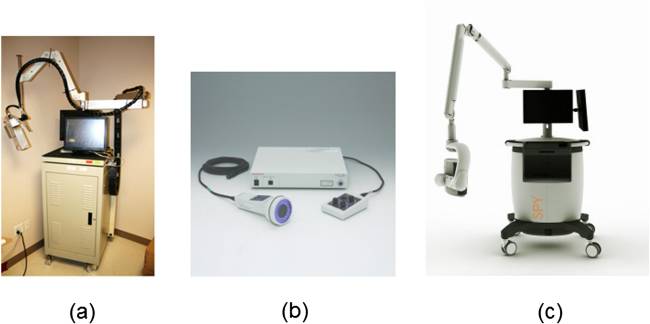
Рисунок 1. Наиболее распространенные устройства для флуоресцентной визуализации в ближнем инфракрасном диапазоне: (a) формирователь изображения FDPM (Центр медицинских наук Техасского университета в Хьюстоне, Техас), (b) фотодинамический глаз (PDE; Hamamatsu Photonics Co., Хамамацу, Япония) и ( c) SPY (Novadaq Technologies Inc., Торонто, Онтарио, Канада).
Разрешения FDA по процедуре 510(k) основаны на том, что устройство является безопасным и эффективным и в значительной степени эквивалентно предикатному устройству. Это все системы флуоресцентной визуализации ICG, показанные вместе с годом их предпродажного одобрения FDA, номером случая и показаниями, для которых они одобрены (рис. 2).

Рисунок 2. Ведущие системы флуоресцентного наведения, оцениваемые здесь, предназначены для использования в открытой хирургии, показаны с относительным приблизительным сравнением размеров. PerkinElmer Solaris, Curadel ResVet Lab-Flare и SurgVision Explorer Air не одобрены 510(k) для использования человеком, в то время как другие предназначены для процедур ICG. Все они имеют возможность отображать ICG в хирургических исследованиях с различными уровнями чувствительности и функциями. Изображения слева направо взяты из системы флуоресцентной визуализации Solaris™ под открытым небом, напечатано с разрешения, (c) 2015-2016 PerkinElmer, Inc., все права защищены; NOVADAQ Spy-Elite™, авторские права принадлежат Novadaq Technologies Inc., 2016; Quest Spectrum™, авторское право Quest Medical Imaging; Fluobeam(R), авторское право Fluoptics, 2016 г.; Хамамацу ПДЭ-Нео™; Lab-FLARE(R) Model R1 авторское право CURADEL; Визионсенс Иридиум™, авторское право Visionsense; Прототип SurgVision Explorer Air, изображение предоставлено SurgVision. Все изображения напечатаны с разрешения правообладателей.
Исследовательские и продаваемые отечественные устройства для флуоресцентной визуализации в ближнем инфракрасном диапазоне
На данный момент на рынке РФ представлена только одна модель флуоресцентной визуализации в ближнем инфракрасном диапозоне. Однако по своим тех. показателям и цене устройство успело зарекомендовать себя перспективным для широкого применения в хирургической специальности.
Система для проведения флуоресцентной диагностики в ближнем инфракрасном (БИК) диапазоне «МАРС» предназначена для наблюдения за кровотоком в артериальном и венозном русле, лимфотоком, перфузией органов и тканей в ходе хирургической операции, в том числе в косметологии.
Для проведения диагностики с помощью данной системы в качестве флуоресцирующего красителя необходим индоцианин зеленый. Индоцианин зеленый – это цианиновый краситель. Применяется в диагностических целях для ангиографии, холангиографии, лимфографии, измерения минутного сердечного выброса и ударного объема, измерения объема циркулирующей крови. Перед применением препарат растворяют в воде для инъекций и вводят внутривенно в дозировке 5 мг/кг массы тела. Индоцианин зеленый возбуждается в инфракрасном диапазоне длин волн 780 нм-810 нм, испускает флуоресцентное излучение в диапазоне длин волн 805 нм-880 нм. Для исследования кровотока, перфузии органов и тканей раствор индоцианина зеленого вводится внутривенно, а для исследования лимфотока используется внутритканевое ( интерстициальное) введение
Система для визуализации флуоресценции работает следующим образом (рисунок 3). Излучение от диодного лазера 785 нм, проходя интерференционный фильтр 1 и оптический модуль, поступает в биологические ткани. В кровеносных сосудах тканей индоцианин зеленый поглощает лазерное излучение, в результате чего образуется флуоресцентное излучение. Рассеянное лазерное и флуоресцентное излучение попадают обратно в оптический модуль, в котором проходят через светоделительное устройство и систему интерференционных фильтров. В результате происходит регистрация флуоресцентного излучения черно-белой камерой с расширенной чувствительностью в ближнем инфракрасном диапазоне, а рассеянного света - цветной камерой. В режиме реального времени на экране монитора выводится изображение цветной камеры, дополненное флуоресцентным изображением. Подкрашенные области показывают области, в которые поступает индоцианин зеленый вместе с кровотоком. Специальное программное обеспечение позволяет записывать дополненный видеосигнал и впоследствии обрабатывать с целью получения значений параметров флуоресцентной ангиографии, площадей свечения. Подобная система для получения и представления дополненного видеосигнала уже была опробована и показала положительные результаты.
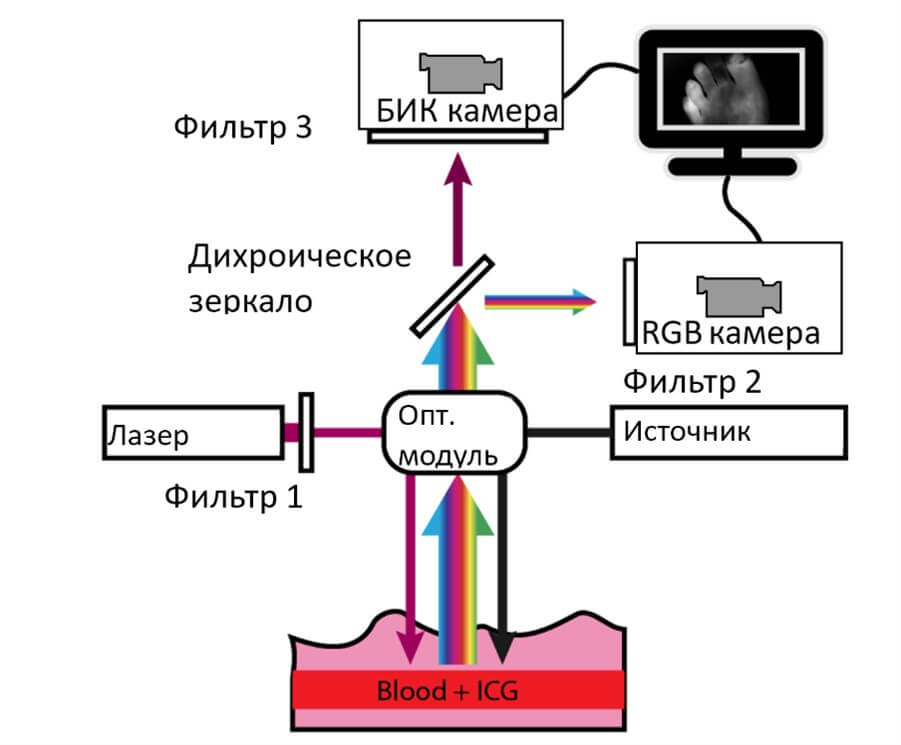
Рисунок 3. Принцип работы видеофлуоресцентной системы для БИК диапазона.
Как происходит определение параметров кровотока с помощью флуоресцентной ангиографии в системе «МАРС»
Для определения параметров кровотока пациенту вводят внутривенно раствор препарата индоцианин зеленый и производят запись флуоресцентного сигнала из интересующей области. Видеозапись обрабатывают. Выделяют в видеофайле интересующую область, далее при помощи специального программного обеспечения рассчитывают динамику средней интенсивности по формуле:
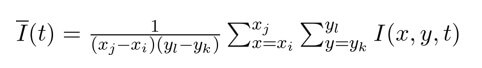
где 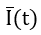 – средняя интенсивность в момент времени t, xj, xi – границы зоны интереса по ширине, yl,yk – границы зоны интереса по высоте, I(x,y,t) – значение яркости в точке с координатами (x,y) в момент времени t.
– средняя интенсивность в момент времени t, xj, xi – границы зоны интереса по ширине, yl,yk – границы зоны интереса по высоте, I(x,y,t) – значение яркости в точке с координатами (x,y) в момент времени t.
На рисунке 4 приведена характерная зависимость средней интенсивности регистрируемого флуоресцентного излучения в выбранной зоне интереса от времени. С целью оценки перфузии в исследуемой области проводится анализ следующих параметров флуоресцентной ангиографии (ФАГ): T0m – время достижения максимальной интенсивности с момента внутривенного введения T0 индоцианина зеленого; TIm- время наступления максимальной интенсивности с момента появления индоцианина зеленого в зоне интереса TI; Imax – уровень максимальной интенсивности, Ibase – начальный уровень сигнала.

Рисунок 4. Характерная динамика интенсивности флуоресценции при проведении ФАГ.
Зная параметры, рассчитывается параметр скорости снабжения кровотока:
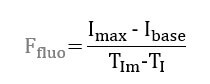
На рисунке 5 представлено: А) флуоресцентное изображение стопы пациента в процессе ФАГ и Б) рассчитанные динамики интенсивности флуоресценции в зонах интереса.

Рисунок 5. А) Флуоресцентное изображение в БИК диапазоне стопы пациента
Б) Динамика интенсивности флуоресценции для выбранной области интереса. Красная область (0) - это «нормальная» область без отеков и предположительно хорошего кровоснабжения. Синяя область (1) является «подозрительной» областью. Он имеет самую низкую интенсивность флуоресценции. Зеленая область (2) - это область, в которой наблюдалась наибольшая интенсивность флуоресценции и ее наиболее быстрый рост.
Для оценки наиболее отличающихся областей, а также для более полного анализа, рассчитывают карту времени наступления максимума интенсивности флуоресценции. Для каждого пикселя изображения рассчитывается время наступления максимума интенсивности флуоресценции. Полученная матрица кодируется цветом.

где T функция времени достижения максимума интенсивности флуоресценции в точке (x, y), H - функция цвета, зависящая от интенсивности, I – интенсивность флуоресценции в точке (x, y) и момент времени t, Tmax общая продолжительность видеофайла.
В результате получается карта времени наступления максимума интенсивности флуоресценции (рис. 6). Желтому соответствует наиболее ранее наступление максимума, а темно-синему наиболее позднее. Таким образом, можно наиболее просто определить участки риска, в которых максимум флуоресценции наступает позднее, относительно соседних участков.
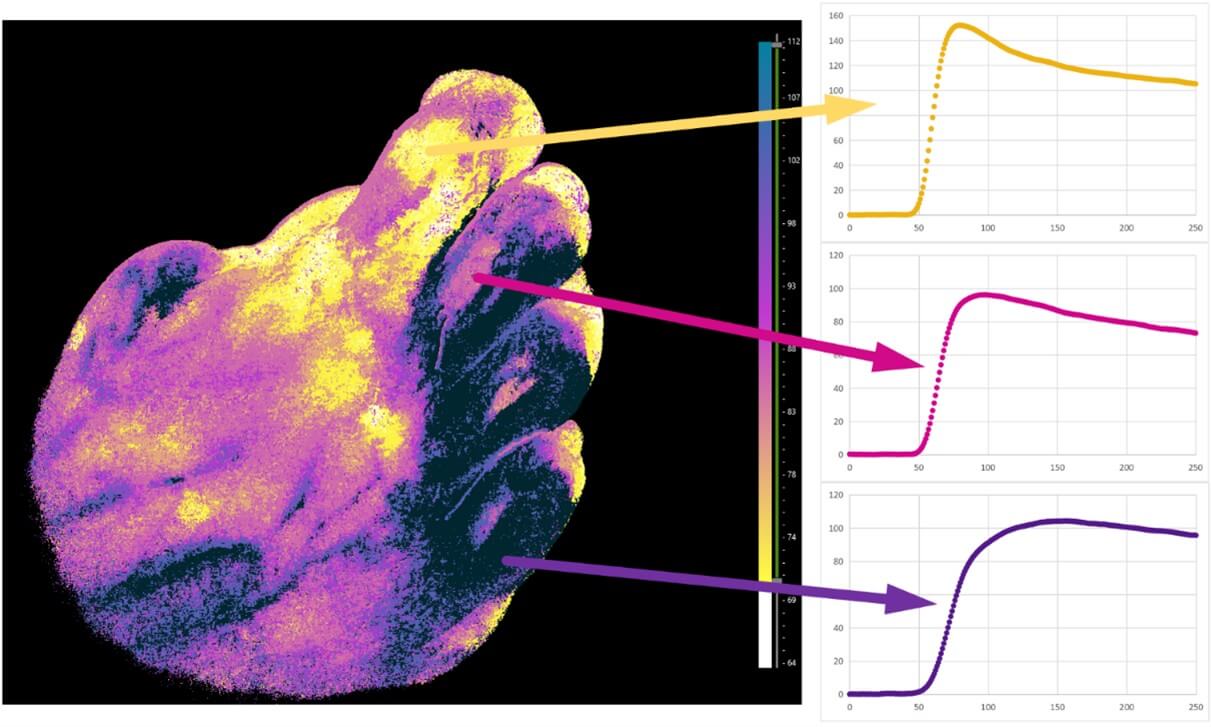
Рисунок 6. Карта времени наступления максимума флуоресценции, получаемая с использованием разработанной системы для ФАГ в БИК диапазоне.
В отделении диабетической стопы ФГБУ «Эндокринологический научный центр» Минздрава России проведена серия работ с включением 90 пациентов с сахарным диабетом (СД) и заболеванием нижних конечностей (ЗАНК) на стадии критической ишемии нижних конечностей.
Проведен статистический анализ значимости рассчитываемых параметров кровотока. Удалось получить их статистически значимую разницу у пациентов в до- и после- операционный период. Так, по данным временных параметров (T0m, TI, TIm), после баллонной ангиоплатстики отмечено сокращение сроков достижения пика максимальной интенсивности вдвое, что коррелировало с положительным исходом процедуры – восстановлением кровотока по берцовым артериям, а также увеличением уровня чрескожного напряжения кислорода в околораневой зоне (52 мм рт. ст.) (критерий Вилкоксона p<0.05).
Разработан протокол проведения ФАГ с индоцианином зеленым у пациентов с СД, ЗАНК и наличием раневых дефектов нижних конечностей. Метод ФАГ для оценки кровотока нижних конечностей у пациентов с СД, осуществляемый разработанной системой, рекомендован Экспертному Совету Министерства Здравоохранения Российской Федерации для включения в клинические рекомендации для диагностики ишемической и нейро-ишемической формы синдрома диабетической стопы у пациентов с сахарным диабетом.
Флуоресцентная диагностика лимфатической системы с помощью системы «МАРС»
При внутритканевом ( интерстициальном) введении раствор индоцианина зеленого попадает в лимфатическое русло. Такое введение препарата называется лимфотропным. Применеие данного метода позволяет определить пути метастазирования злокачесвенных новообразований. При раке молочных желез индоцианин зеленый вводится внутрикожно в область ареолы сока в нескольких местах (рис. 7А). При попадании в лимфоток, индоцианин зеленый позволяет визуализировать первый лимфоузел на пути оттока лимфы от патологического очага (сторожевой или сигнальный) (рис. 7Б), что позволяет, при гистологическом исследовании, определить наличие или отсутствие микрометастазов в сигнальных лимфоузлах и более точно стадировать заболевание.
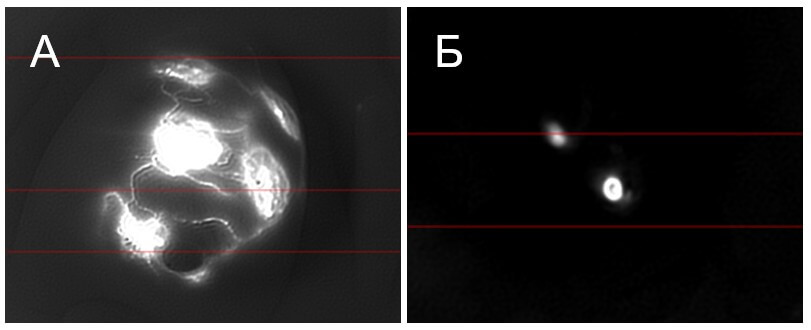
Рисунок 7. А) Флуоресценция индоцианина зеленого в местах введения в молочной железе и в лимфатическом русле. Б) Флуоресценция индоцианина зеленого сторожевых узлах.
Другим направлением развития лимфотропного введения индоцианина зеленого является лимфостаз – хроническое прогрессирующее заболевание, вызванное нарушением оттока лимфы вследствие пересечения значимых лимфатических сосудов при операциях удаления злокачественных новообразований. Лимфография при помощи индоцианина зеленого-минимально инвазивный метод визуализации в пред- и интраоперационном периоде. Метод полезен для обнаружения лимфатических сосудов путем картирования линейных структур для разработки и выполнения пластических сосудистых операций.
Заключение
Визуализация NIRF (Near-Infrared Fluorescence) быстро становится все более популярной в клинической практике хирургов различного профиля. В этом обзоре мы рассмотрели производительность различных устройств для визуализации NIRF в клинической практике, использующих флуоресценцию ICG (Indocyanine Green). Каждая система имеет свой собственный набор положительных и отрицательных аспектов. На рынке не существует единственной «лучшей» системы. В связи с тем, что в настоящее время существует множество устройств для визуализации в NIR диапазоне и используются различные дозы ICG, необходимо провести критическую оценку эффективных подходов для дальнейшего развития технологий, основанных на визуализации с молекулярным нацеливанием.
Список литературы:
- B Zhu, PhD and E M Sevick-Muraca, PhD: A review of performance of near-infrared fluorescence imaging devices used in clinical studies; 2014.
- Pablo A. Valdés, MD, PhD, David W. Roberts, MD, Fa-Ke Lu, PhD, and Alexandra Golby, MD: Optical technologies for intraoperative neurosurgical guidance; 2016.
- Jian Zhou, Fan Yang, corresponding author Guanchao Jiang, and Jun Wang: Applications of indocyanine green based near-infrared fluorescence imaging in thoracic surgery; 2016.
- Jian Zhou, Fan Yang, corresponding author Guanchao Jiang, and Jun Wang: Applications of indocyanine green based near-infrared fluorescence imaging in thoracic surgery; 2016.
- Pablo A. Valdés, MD, PhD, David W. Roberts, MD, Fa-Ke Lu, PhD, and Alexandra Golby, MD: Optical technologies for intraoperative neurosurgical guidance; 2016.


